الکتروفورز
الکتروفورز پروتئین
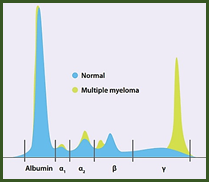
الکتروفورز پروتئین های سرم روشی آسان و ارزان برای جداسازی و بررسی کمی پروتئین های سرم و ادرارمی باشد که بر اساس بار خالص، اندازه و شکل آن ها انجام می شود. سرم حاوی بیش از هزار پروتئین است که هر یک عملکردهای ویژه خود را دارند و غلظت آنها تحت شرایط پاتولوژیک متفاوت، تغییر می کند. پروتئین های سرم بر پایه بار الکتریکی خود به پنج بخش مجزا شامل آلبومین، آلفا ۱- گلوبولین (α۱)، آلفا ۲- گلوبولین (α۲)، بتاگلوبولین (β) و گاماگلوبولین (γ) تفکیک می شوند.
ارزیابی اجزای پروتئین های سرم برای تشخیص، بررسی و کنترل دوره بیماری مبتلایان به سرطان (لنفوم، میلوما)، بیماری های
روده ای- کلیوی همراه با دفع پروتئین، اختلالات کبدی، اختلالات ایمنی، مونوکلونال گاماپاتی ها، میلوم متعدد، ماکروگلوبولینمی والدن اشتروم، سوء تغذیه و بیماری های مزمن همراه با ادم استفاده می گردد.
روند جداسازی پروتئین ها شامل قرار دادن آن ها در یک ماتریکس و سپس مشاهده ی حرکت پروتئین در حضور یک میدان الکتریکی می باشد. پروتئین ها از اتصال کووالان اسید آمینه ها تشکیل شده اند و دارای اندازه و بارهای الکتریکی متفاوتی هستند، بنابراین می توان آنها را از نظر الکتروشیمیایی جدا نمود. پروتئین ها در یک بافر قلیایی (PH=5.8-9) شارژ منفی می گیرند و از الکترود منفی به سمت الکترود مثبت مهاجرت می کنند. ماتریکس الکتروفورز، ژل آگارز است و پروتئین ها بر اساس تراکم بار سطحی خود از یکدیگر جدا می شوند.
پروتئین توتال
پروتئین ها در ساختار عضلات، آنزیم ها، هورمون ها، پروتئین های ناقل و سایر اجزای عملکردی و ساختاری بدن شرکت می کنند. سطح پروتئین های سرم در سوء تغذیه ، بعد از جراحی، بیماران دچار سوختگی، مبتلایان به انتروپاتی و اوروپاتی کاهش می یابد. همچنین در سه ماهه سوم بارداری کاهش میزان پروتئین توتال مشاهده می شود. در بعضی بیماری ها مانند بیماری های مزمن کبدی فقط آلبومین کاهش می یابد و میزان گلبولین ها طبیعی بوده و یا برای حفظ سطح کلی پروتئین تام افزایش یافته اند. در این بیماری ها اگر نسبت آلبومین به گلبولین را اندازه گیری نمایید، این تغییرات قابل شناسایی خواهند بود. به طور معمول این نسبت باید از ۱ بیشتر باشد. در بعضی از بیماری ها نظیر مولتیپل میلوما و گاماپاتی ها افزایش سطح پروتئین توتال روی می دهد. پروتئین توتال سرم ترکیبی از پره آلبومین، آلبومین و گلوبولین ها می باشد. در انجام الکتروفورز پروتئین آلبومین با فاصله بیشتری حرکت نموده است، به دنبال آن تعدادی باند گلوبولینی که به ترتیب β،α۲،α۱ ( معمولا به β۱ و β۲ تجزیه می شود) و نهایتا γ گلوبولین مشخص می شوند.
مقادیر طبیعی: ۸٫۳ –۶٫۴ گرم در دسی لیتر
آلبومین
آلبومین پروتئین اصلی سرم که اغلب دو سوم (۶۰ درصد) پروتئین توتال را تشکیل می دهد، در کبد ساخته می شود. مهمترین عمل آلبومین در خون حفظ فشار اسموتیک کلوئیدی می باشد. همچنین آلبومین حمل کننده داروها، هورمون ها و آنزیم ها در خون می باشد. نیمه عمر آن ۱۸-۱۲ روز است. بلندترین قله (به صورت یک تک باند بلند) و نزدیکترین باند به الکترود مثبت را در الکتروفورز به خود اختصاص می دهد.
- آلبومین معیار خوبی برای ارزیابی عملکرد کبد می باشد.
- عواملی مانند سوء تغذیه، بارداری، بیماری کبدی (سیروز، هپاتیت و نکروز کبدی)، افزایش حجم خون، عفونت های حاد، سندرم نفروتیک، انتروپاتی های توأم با دفع پروتئین و بیماری های التهابی منجر به کاهش آلبومین می شوند.
- کم شدن آب بدن (Dehydration) یکی از دلایل افزایش آلبومین می باشد.
- حرکت بیش از حد آلبومین به سمت آند در نتیجه اتصال به بیلی روبین، اسیدهای چرب غیر استریفیه، پنی سیلین و استیل سالیسیلیک اسید و در بعضی مواقع در پانکراتیت حاد روی می دهد.
مقادیر طبیعی: ۵-۳٫۵ گرم در دسی لیتر
گلوبولین ها
گلوبولین ها بخش بسیار کوچکتر از کل پروتئین های سرم را تشکیل می دهند. همان طور که گفته شد پنج طبقه بندی از گلوبولین ها وجود دارد:β۲،β۱،α۲،α۱ و γ که نزدیکترین باند به الکترود منفی، γ است. نقش گلوبولین ها در حفظ فشار اسمزی بسیار کمتر از نقش آلبومین است.
مقادیر طبیعی: ۳٫۴ -۲٫۳ گرم در دسی لیتر
آلفا ۱- گلبولین
آلفا ۱- آنتی تریپسین یک پروتئین واکنشگر حاد است که بیشتر آلفا۱- گلبولین ها را تشکیل می دهد. بعضی از پروتئین های ناقل نظیرگلوبولین پیوندشونده به کورتیکواستروئید (CBG) و گلوبولین متصل به تیروکسین (TBG) نیز دراین ناحیه قرار می گیرند.
- آلفا ۱- آنتی تریپسین نوعی پروتئین فاز حاد است که در بیماری هایی که همراه با التهاب، نکروز، انفارکتوس، بدخیمی یا سوختگی افزایش می یابد.
- کاهش یا فقدان ژنتیکی آنزیمی آلفا ۱- آنتی تریپسین (آمفیزم ریوی جوانان) موجب کاهش سطح آلفا-۱- گلوبولین
- می شود این آنزیم نقش مهمی در عملکرد طبیعی ریه دارد.
- پروتئین بنس جونز (Bence Jones Protein) می تواند به α۱ متصل شده و باعث تاخیر در حرکت باند α۱ گردد.
مقادیر طبیعی: ۰٫۳ – ۰٫۱ گرم در دسی لیتر
آلفا ۲- گلبولین
آلفا ۲ گلبولین ها شامل سرولوپلاسمین، α۲ ماکروگلوبولین، پروترومبین، کولین استراز و هاپتوگلوبین می باشند.
- سرولوپلاسمین و هاپتوگلوبولین از پروتئین های واکنشگر فاز حاد هستند که در بیماری های التهابی ، نکروز، انفارکتوس، بدخیمی یا سوختگی افزایش می یابند.
- سندرم نفروتیک همراه با افزایش سطح آلفا-۲- گلوبولین می باشد. . افزایش باند α۲ ممکن است به دلیل وجود پروتئین های بزرگ و عدم توانایی عبور آنها از گلومرول باشد.
- آلفا ۲- ماکروگلوبولین در شرایط نفروپاتی در افراد دیابتیک مقدار کمی افزایش می یابد.
- همولیز (کاهش هاپتوگلوبولین)، بیماری ویلسون (کاهش سرولوپلاسمین)، پر کاری تیروئید و اختلال شدید عملکرد کبد (کاهش هاپتوگلوبولین) موجب کاهش سطح آلفا-۲- گلوبولین می شود.
مقادیر طبیعی: ۱-۰٫۶ گرم در دسی لیتر
بتا گلوبولین ها
این ناحیه از دو بخش β۱ و β۲ تشکیل شده است اما به صورت یک تک باند مشاهده می شود. β۱ از لیپو پروتئین ها، پلاسمینوژن، ترانسفرین و پروتئین های کمپلمان تشکیل شده است و β۲ شامل فیبرینوژن می شود.
- هیپرکلسترولمی (به تنهایی و یا همراه با سیروز صفراوی، کم کاری تیروئید یا نفروز روی می دهد) با افزایش سطح بتا گلوبولین ها همراه است.
- در شرایطی مثل آنمی فقر آهن (افزایش ترانسفرین) ، بارداری و درمان با استروژن سطح بتا گلوبولین ها افزایش می یابد.
- در سوء تغذیه ( کاهش ترانسفرین) موجب کاهش بتا گلوبولین ها می شود.
مقادیر طبیعی: ۱٫۲-۰٫۷ گرم در دسی لیتر
گاما گلوبولین ها
گاما گلبولین ها، ایمونوگلوبولین ها هستند که شامل lgD،lgG،lgM،lgA و IgE می شوند.
- سندرم فقدان و یا نقص گاما گلبولین ها نظیر نقص IgA با کاهش سطح گاما گلبولین ها در ارتباط هستند.
- بیماری های مولتیپل میلوما، ماکروگلوبولینمی والدن اشتروم،بیماری های التهابی مزمن (نظیرآرتریت روماتوئید، لوپوس اریتروماتوز سیستمیک و اسکلرودرما)، بیماری های بدخیم (بیماری هوچگین، لنفوم و لوسمی)، عفونت حاد و مزمن، سیروز واختلالات خونی باعث افزایش سطح گاماگلوبولین می شوند.
- بیماران با سیروز دارای افزایش سطح گاماگلوبولین و گاهی افزایش بتاگلوبولین می باشند.
- اختلالات ژنتیکی در سیستم ایمنی و عواملی نظیر مصرف استروئیدها، سندرم نفروتیک، عفونت شدید با باکتری های گرم منفی، لنفوم و لوسمی با کاهش سطح ایمونوگلوبولین ها همراه هستند.
مقادیر طبیعی: ۱٫۶ -۰٫۶ گرم در دسی لیتر
توجه:
- در صورت مشاهده افزایش قله γ، اولین گام در تفسیر، باریک یا پهن بودن ناحیه است.
- در صورتی که افزایش آن به صورت تک قله باریک و میخ مانند (Spike like) باشد نشان دهنده تولید آنتی بادی مونوکلونال یک ایمونوگلوبولین است (گاماپاتی مونوکلونال) (شکل الف)، در حالی که یک قله پهن و تاول مانند (Swell like) نشان دهنده تولید ایمونوگلوبولین پلی کلونال است (شکل ب).
- بیماری های کبدی، خود ایمنی بیماری های بافت همبند (روماتوئید آرتریت، لوپوس، اسکلرودرما و سندرم شوگرن)، بیماری های مزمن ویروسی و باکتریایی و بسیاری از بدخیمی های خونی (لوکمی لنفوپاتیک مزمن، تالاسمی و آنمی سیکل سل) و غیر خونی کارسینومای تخمدان، ریه و..) می توانند باعث افزایش پلی کلونال ناحیه γ شوند.
- ایمونوفیکساسیون الکتروفورز برای تشخیص و تأیید ایمونوگلوبولین های مونوکلونال انجام می شوند. این آزمایش اجزای تشکیل دهنده گاما گلبولین ها (ایمونوگلبولین ها) اندازه گیری می شود.
- ایمونوفیکساسیون الکتروفورز به ویژه برای شناسایی گاماپاتی های منوکلونال از قبیل مولتیپل میلوما و ماکروگلوبینمی والدن اشترم مفید است.
- هایپوگاماگلوبولینمیا (فقدان یا کاهش ناحیه ی γ ) در بیماران مبتلا به X-Linked agammaglobulinemia به راحتی در الکتروفورز پروتئین قابل شناسایی می باشد.
- میزان IgG یا IgA با مقادیر بیش از ۳ گرم در دسی لیتر ممکن است با بیماری مولتیپل میلوما در ارتباط باشد.
- میزان آلبومین (۲> گرم در دسی لیتر)، آلفا ۲ (۱٫۱ < گرم در دسی لیتر) و باند گاما (۱ > گرم در دسی لیتر) با سندرم نفروتیک در ارتباط می باشد و باید پروتئین مونوکلونال مورد پیگیری قرار گیرد.
عوامل مداخله گر:
- همولیز ممکن است فراکسیون بتا را تقویت کند.
- داروهایی مانند استروئیدهای آنابولیک، کورتیکواستروئیدها، آندروژن ها، هورمون رشد، انسولین، فنازوپیریدین و پروژسترون موجب سطوح بالای پروتئین می شوند.
- استروژن، قرص های ضدبارداری خوراکی، یون های آلومینیوم و داروهای هپاتوتوکسیک موجب کاهش پروتئین می شوند.
- فیبرینوژن ممکن است به عنوان یک باند مجزا در فراکسیون بتا و گاما مشاهده شود.
- پنی سیلین ممکن است موجب شکاف باند آلبومین گردد.
- مواد رادیوگرافی ممکن است الگوی غیر قابل تفسیری از الکتروفورز پروتئین ایجاد کند.
توجه:
- بهترین نمونه برای این الکتروفورز، سرم تازه است و باید از نمونه پلاسما برای انجام این آزمایش خودداری شود، زیرا وجود فیبرینوژن در نمونه منجر به بروز یک باند نازک و مشخص در بین بخش های β و γ خواهد شد.
- نمونه خون باید در لوله های جداکننده سرم جمع آوری شود.
- در مورد ادرار نمونه اول صبح و یا ترجیحا ادرار ۲۴ ساعته جمع آوری شود. در مدت نگهداری در یخچال نیاز به ماده نگهدارنده نمی باشد.
الکتروفورز پروتئین های ادرار
در حالت طبیعی مقدار بسیار کمی پروتئین (حدود ۱۵۰ میلیگرم درشبانه روز ) در ادرار دفع می شود که این میزان بسیار ناچیز بوده و با روشهای معمول بررسی پروتئین ادرار قابل ارزیابی نمی باشد. این پروتئین ها از پلاسما و دستگاه ادراری منشا می گیرند. حدود یک سوم آلبومین و بقیه پروتئین های پلاسما به ویژه پروتئین هایی از دسته گلوبولین ها، بتا ۲ میکروگلوبولین ،زنجیره سبک ایمونوگلوبولین و لیزوزیم می باشند. گلیکوپروتئین تام هورسفال ترشح شده از سلول های لوله انتهایی حدود یک سوم و یا بیشتر پروتئین های تام دفعی طبیعی را تشکیل می دهد. ایمونوگلبولین A ترشحات دستگاه ادراری، آنزیم ها و پروتئین های سلول های اپی تلیال به مقدار ناچیزی در ادرار طبیعی یافت می شوند. در افراد سالم ممکن است هنگام ورزش یا از دست دادن آب مقدار پروتئین ادرار افزایش یابد. میزان پروتئین ادرار تحت شریط پاتولوژیک نظیر بیماری های کلیوی، بیماری های اتوایمیون و بیماری مولتیپل میلوما افزایش می یابد.
برای تشخیص نوع پروتئین ادرار نیاز به الکتروفورز و جداسازی پروتئین های ادرار و سرم می باشد. الکتروفورز پروتئینهای ادرار، آنها را براساس بار الکتریکی جدا کرده و نوع آسیب کلیوی را مشخص میکند. براساس این آزمایشات و یافته های بالینی پروتئینوری را می توان به نوع گلومرولی و لوله ای تقسیم کرد که هریک نشانگر ضایعه ای در بخشی از نفرون است. همچنین نوع سوم پروتئینوری که در ابتدا با بیماری گلومرول یا لوله ای همراه نبوده ولی ممکن است موجب بیماری کلیه شود.
در پروتئینوری گلومرول مقادیر زیادی آلبومین و پروتئین هایی نظیر آنتی ترومبین، ترانسفرین، پرآلبومین، آلفا ۱ اسید گلیکوپروتئین و آلفا ۱ آنتی تریپسین دفع می شود. سندرم نفروتیک با بیماری گلومرولی همراه است.
در پروتئینوری لوله ای پروتئین هایی با وزن مولکولی پایین نظیر آلفا ۱ میکروگلوبولین، بتا ۲میکرو گلوبولین، ایمونوگلوبولین های زنجیره سبک و لیزوزیم در ادرار دفع می شوند که باید به میزان زیادی جذب شوند.
مولتیپل میلوما یک نوع بدخیمی در سلولهای تولید کننده آنتی بادی است که این سلولها شروع به تولید گاماگلبولین های منوکلونال کرده که در اغلب موارد این پروتئینها شامل زنجیره سبک آنتی بادی نیز می باشد و در نتیجه این زنجیره ها از کلیه عبور کرده و وارد ادرار می شود. گاموپاتی منوکلونال (M-protein) در میلوم مولتیپل، ماکروگلوبولینمی والدن اشتروم، بیماریهای لنفوپرولیفراتیو از جمله CLL و آمیلوئیدوز سیستمیک اولیه دیده میشود.
توجه:
- الکتروفورز پروتئین ادرار در تشخیص بیماران با گاماپاتی مونوکلونال استفاده می شود، البته این آزمایش به تنهایی برای تشخیص بیماری کافی نیست.
- به طور معمول در صورت مشاهده افزایش باند گاماگلبولین های الکتروفورز پروتئینهای ادرار برای تایید از روشی دیگری به نام Immunofixation Electrophoresis استفاده می شود.
- حضور یک زنجیره سبک مونوکلونالM-spike بیش از یک گرم در ۲۴ ساعت با مولتیپل مایلوما یا ماکروگلوبولینمی در ارتباط است.
- حضور مقادیر کم از زنجیره سبک مونوکلونال و پروتئینوری ( پروتئین تام بیش از۳ گرم در ۲۴ ساعت) که به طور عمده آلبومین باشد، با تشخیص بیماری آمیلوئیدوز و یا بیماری رسوب زنجیره سبک (LCDD) مرتبط می باشد.
- بیماران مشکوک به گاماپاتی مونوکلونال ممکن است الگوی الکتروفورز پروتئین ادرار طبیعی داشته باشند، در این صورت برای تایید بیماری آزمایش ایمونوفیکساسیون ضروری می باشد.
- همولیز ممکن است یک باند مجزا در الگو ی الکتروفورز پروتئین ایجاد نماید که در ایمونوفیکساسیون منفی خواهد بود.
- پنی سیلین ممکن است در باند آلبومین شکاف ایجاد کند.
- مواد رادیوگرافی ممکن است الگوی غیر قابل تفسیری از الکتروفورز پروتئین را بوجود آورند.
مقادیر طبیعی:
پروتئین توتال: ۱۵۰ میلیگرم در ۲۴ ساعت
الکتروفورز هموگلوبین

انواع هموگلوبين:
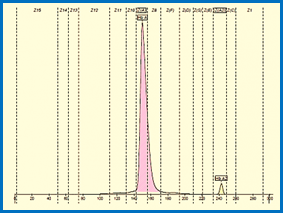
هموگلوبين A2: حدود ۲ تا ۳ درصد کل هموگلوبین را در افراد بالغ تشکیل میدهد.
 هموگلوبين F (هموگلوبين جنيني):
هموگلوبين F (هموگلوبين جنيني):
هموگلوبین F تنها در حضور مقادیر کم اکسیژن (دوران جنینی) قادر به انتقال آن می باشد.حدود ۱ تا ۲ درصد کل هموگلوبین را در افراد بالغ تشکیل میدهد. این هموگلوبین اولین هموگلوبینی است که در دوران بارداری در جنین تولید میشود و کمی بعد از تولد، تولید آن کاهش یافته و با هموگلوبين A جايگزين مي شود وحدود ۱ تا ۲ سال بعد به میزان ۱ تا ۲ درصد میرسد. در بعضي از بيماري ها مثل کم خوني سلول هاي داسي شکل، کم خوني آپلاستيک و لوسمي، ميزان هموگلوبين F افزايش مي يابد. همچنین در بیماران نیازمند به جبران هیپوکسی مزمن طولانی ممکن است میزان هموگلوبین F برای کمک به انتقال اکسیژن افزایش یابد.
مقادیر طبیعی:
نوزادان کمتر از ۲۸ روز ۸۰-۵۰ درصد
نوزادان کمتر از ۶ ماه < 8 درصد
نوزادان بیشتر از ۶ ماه ۲-۱ درصد
 هموگلوبين S
هموگلوبين S
اين نوع هموگلوبين در کم خوني سلول هاي داسي شکل يافت مي شود. کم خونی داسی شکل حاصل یک جهش ژنی میباشد که طی آن یک نوکلئوتید با باز آلی تیمین جای خود را با یک نوکلئوتید دیگر با باز آلی آدنین عوض میکند.سلولهای هموگلوبین سلول داسی سفت و به شکل داس میباشند و تمایل دارند به شکل خوشهای و در کنار یکدیگر قرار گیرند. این تغییر شکل باعث می شود که جریان طبیعی گلبول های قرمز در داخل مویرگ های خونی مختل شود ، در نتیجه میزان اکسیژن رسانی کاهش یافته و طول عمر گلبولها از مقدار طبیعی ۱۲۰ روز به ۲۰-۱۰ روز کاهش می یابد. میزان هموگلوبین S در افراد طبیعی صفر می باشد.
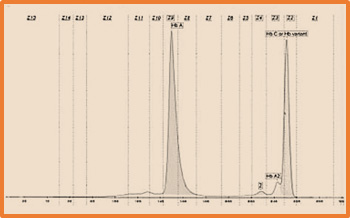
 هموگلوبین C
هموگلوبین C
هموگلوبینC به علت جايگزيني اسيد آمينه ليزين به جاي گلوتاميك در موقعيت ۶ زنجيره ی بتا هموگلوبین بوجود می آید. بیماری هموزیگوت هموگلوبین C یک بیماری خفیف، اغلب بدون علائم بالینی وهمراه با اسپلنومگالی می باشد که گاهی موجب زردی و احساس ناراحتی در ناحیه شکم می گردد. گلبولهای قرمزی که فقط حاوی هموگلوبین C هستند، شکننده تر و آسیب پذیرتر از گلبولهای قرمز معمولی هستند. این عامل باعث ایجاد کم خونی خفیف تا متوسط در فرد مبتلا می شود. در این افراد كم خوني نورموكرم نورموسيتيك و تا حدي ميكروسيتيك همراه با تعدادي اسفروسيت و تارگت سل به همراه افزایش اندکی در رتیکولوسیت مشاهده می شود. در اسمیر خونی ممکن است بعد از طحال برداری در گلبول ها کریستال های کشیده مشاهده گرد.
میزان هموگلوبین C در افراد طبیعی صفر می باشد.
توجه:
- در صورت مشاهده نتایج غیرطبیعی آزمایش CBC نیز این آزمایش درخواست میشود و به عنوان بخشی از برنامه غربالگری نوزادان نیز میباشد.
- افزايش ميزان هموگلوبين A2 و هموگلوبين F ممکن است به دليل بيماري تالاسمي خفيف باشد.
- کاهش شديد ميزان هموگلوبين A و افزايش ميزان هموگلوبينF ممکن است به علت تالاسمي شديد باشد.
- در بتاتالاسمی مینور غلظت هموگلوبینA2 بیش از ۳٫۳ درصد بوده و غلظت هموگلوبینF به طور معمول ۲۰-۵ درصد هموگلوبین تام است و در بتاتالاسمی ماژور مقدار هموگلوبین F حدود ۹۰-۷۰ درصد هموگلوبین تام است. افزایش جزئی غلظت Hb F در بیماری های خونی نظیر آنمی و لوسمی حاد دیده می شود.
- وجود هموگلوبين S و C به معني بيماري هموگلوبين S-C است که نوع خفيف و متوسط بيماري سلول هاي داسي شکل است.
- انتقال خون در طی ۱۲ هفته قبل ممکن است به علت رقیق شدن غیر طبیعی هموگلوبین سبب تغییر نتایج آزمایش شود.
منابع برگزیده:
- HENRY’S Clinical Diagnosis and Management by Laboratory Methods 22 nd EDITION Richard A. McPherson, MD -2011
- Mosby’s Manual of Diagnostic and Laboratory Tests, 4th Edition By Kathleen Deska Pagana, PhD, RN and Timothy J. Pagana, MD, FACS
- mayomedicallaboratories.com
- Serum protein electrophoresis-Helena
- Serum protein electrophoresis-Medscape
دستگاه ها و تجهیزات بخش الکتروفورز

عزيزاني که ساکن اهواز هستند ميتوانند از آزمايشگاه پاستور اهواز با بهترين امکانات و تکنولوژي روز، جهت هر نوع آزمايشي استفاده نمايند.
با تشکر مديريت سايت آزمايشگاه اهواز – پاستور




 هموگلوبين F (هموگلوبين جنيني):
هموگلوبين F (هموگلوبين جنيني):
 هموگلوبین C
هموگلوبین C




ممنون از سایت خوبی که دارید. موفق باشید