تشخیص بیماریهای نقص ایمنی
نقص ایمنی
سیستم ایمنی دارای دو بخش به نام های ایمنی ذاتی و ایمنی اکتسابی می باشد. ایمنی ذاتی شامل سدهای فیزیکی و شیمیایی مانند پوست و مخاط، پروتئین های شناور در پلاسما مانند پروتئین های کمپلمان، سلول های بیگانه خوار نظیر نوتروفیل ها، ماکروفاژها و سلول های کشنده طبیعی است. ایمنی اکتسابی دارای دو بازوی مهم به نام های ایمنی سلولی و هومورال می باشد. مهمترین سلول ها در ایمنی سلولی لنفوسیت های T و در ایمنی هومورال، لنفوسیت های B هستند. مکانیسم های اجرایی لنفوسیت T توسط خود لنفوسیت های T و تا حدودی توسط ماکروفازهای فعال شده صورت می گیرد. لنفوسیت های B نقش تولید و ترشح ایمونوگلوبین ها را بر عهده دارند. هر دوی این سلول ها در برابر آنتی ژن فعال شده و پاسخ اختصاصی ایجاد می نمایند. این در حالی است که در ایمنی ذاتی پاسخ ایمنی اختصاصی از اهمیت کمتری برخوردار است.
نقص ایمنی (Immunodeficiency) به معنی عملکرد نامناسب سیستم ایمنی بدن است؛ به گونهای که افراد نسبت به انواع عفونتها مستعد میشوند. کمبود ایمنی میتواندبه صورت اولیه و ثانویه یا اکتسابی باشد. بیشتر نقایص ایمنی اولیه ناشی از نواقص ژنتیکی مادرزادی یا عملکرد سیستم ایمنی بوده و اساس ژنتیکی دارند. در نقایص ایمنی ثانویه عللی غیر از سیستم ایمنی مثل عفونتهای باکتریال یا ویروسی، سوء تغذیه یا درمان با داروهای سرکوبگر ایمنی باعث نقص ایمنی شدهاند. مشهورترین کمبود ایمنی ثانویه بیماری ایدز (AIDS) است.
ارزیابی سیستم ایمنی
ارزیابی سیستم ایمنی اغلب با یک آزمایش فرمول شمارش (CBC)، گسترهی خون محیطی و سرعت رسوب گلبول های قرمز (ESR) آغاز میگردد. هدف از انجام این بررسیها شناسایی لکوپنی، لنفوپنی، نوتروپنی، نوتروفیلی و اشکال غیر طبیعی در سلول های خون محیطی و احتمال وجود عفونت باکتریایی می باشد.
بررسی عملکرد لنفوسیت های B
کمبود آنتی بادی شایعترین نوع، در بین نقصهای اولیه ایمنی است که به علت عدم تمایز لنفوسیتهای B در مغز استخوان و یا بافتهای لنفی محیطی و به دنبال آن عدم توانایی لنفوسیتهای B برای ترشح پادتن به میزان کافی و یا با کیفیت مطلوب روی می دهد. بیماران مبتلا به کمبود اولیه آنتی بادی مستعد ابتلا به انواع عفونتهای باکتریایی هستند.
اولین آزمایش برای بررسی عملکرد لنفوسیت های B اندازه گیری ایمونوگلبولین های سرم است. سنجش کمی IgA، IgG وIgM با روش های ELISA و یا SRID به تشخیص کمبود کلی ایمونوگلبولین ها کمک می نماید همچنین در تشخیص کمبود انتخابی یک یا چند کلاس ایمونوگلبولین مفید می باشد. در بررسی لنفوسیت های B ، الکتروفورز پروتئین های سرم، ایمونوالکتروفورز و ایمونوفیکساسیون الکتروفورز حساسیت و توانایی کافی سنجش کمی را دارا نیستند.
- بیماران مبتلا به نقایص آنتیبادی اغلب میزان پایین آنتیبادی سرمی دارند اما گاهی مقدار آنتیبادیها طبیعی است ولی عملکرد آن ها طبیعی نیست.
- شایعترین%۸۸کمبود اولیه آنتی بادی کمبود انتخابی IgA است.
- نقص ایمنی متغیر شایع (CVID)،سندرومی است که با کاهش آنتی بادیها درگردش خون و عدم توانایی در تولیدآنتی بادی های اختصاصی همراه با تعداد طبیعی سلولهای B محیطی مشخص میشود. توزیع جنسی در CVID تقریبا مساوی است و مردان و زنان را بطور یکسان مبتلا میکند. بروز عفونتهای مکرر در بیماران میتواند در هر سنی شروع شود ولی نخستین علایم بیشتر در دو محدوده سنی ۱-۵ و ۱۶-۲۰ سالگی تظاهر میکنند.
- بيماري آگاماگلوبولينمي وابسته به جنس نوعي نقص ايمني اوليه بوده كه علايم آن شامل عفونت هاي مکرر باكتريايي، كمبود شديد آنتي بادي هاي سرمي و كاهش لنفوسيت هايB خون مي باشد. بروز جهش در ژن BTK(ژن کد کننده تیروزین کیناز بروتون) موجب بروز اين بيماري مي شود. این بیماری که به آن آگاماگلوبولینمی وابسته به جنس یا به اختصار XLA گفته می شود، تنها در مردان دیده میشود.
بررسی عملکرد لنفوسیت های T
لنفوسیت های T در مقایسه با لنفوسیت های B عملکرد پیچیده تری دارند. و به همین دلیل ارزیابی عملکرد آن ها مشکل تر می باشد. همچنین آزمایشاتی ساده، ارزان قیمت و قابل اطمینان اندکی برای بررسی عملکرد سلول های T وجود دارند.
واکنش حساسیت پوستی تاخیری
این آزمایش با استفاده از مجموعه ای از آنتی ژن ها برای غربالگری در بزرگسالان و کودکان (به استثنای نوزادان و شیرخواران) استفاده می شود. نتیجه مثبت در آزمایش حساسیت پوستی تاخیری در اغلب موارد نشانه ای از عملکرد طبیعی سلول های T و ایمنی سلول به شمار می آید. البته باید این نکته را متذکر شد که نتیجه مثبت در آزمایش حساسیت پوستی تاخیری که با گروهی از آنتی ژن ها انجام شده است نمی تواند نشانه مطمئنی از عملکرد طبیعی سیستم ایمنی سلولی در مقابل سایر آنتی ژن ها باشد. برای نمونه در بیماری کاندیدیازیس مزمن جلدی- مخاطی ممکن است عملکرد سیستم ایمنی نسبت به همه آنتی ژن ها غیر از کاندیدا طبیعی باشد. علاوه بر این نتیجه مثبت این آزمایش منوط به برخورد قبلی فرد با آنتی ژن می باشد. برای مثال افراد آنتی ژن را از طریق واکسن و یا ابتلا به عفونت دریافت کرده باشند اما در نوزادان ممکن است هنوز با بعضی از آنتی ژن ها برخورد نکرده باشند.بنابراین آزمایش حساسیت پوستی در آن ها منفی می باشد و این نتیجه منفی دال بر اختلال سیسنم ایمنی سلولی نمی باشد.
بررسی سایتوکاین ها
سایتوکاین ها، پروتئین هایی هستند که از سلولهای ایمنی ذاتی و اکتسابی ترشح می شوند وواکنش های التهابی و ایمنی را تحریک و تنظیم می نمایند. با توجه به اثرات بیولوژیک ویژه هر سایتوکاین کمبود یا ازدیاد هر کدام از آنها منجر به بیماری و اختلال در سیستم ایمنی فرد می شود.در حال حاضر امکان ارزیابی سایتوکاین های ترشح شده از لنفوسیت های B وT نظیر اینترفرون گاما، TNF-α و اینترلوکین دو با روش های الایزا، رادیوایمونواسی، کمی لومینسانس و غیره وجود دارد.
آزمایش کشت مخلوط لکوسیتی MLC(Mixed Lymphocyte Culture )
در این آزمایش چنانچه لنفوسیت های دو نفر را که از نظر آنتی ژنهای کلاس II با هم متفاوتند با یکدیگر مجاور کنند، لنفوسیت های هر فرد در مقابل لنفوسیت های دیگری تحریک شده و تزاید می یابد. برای سهولت درک واکنش به طور معمول يك نمونه را تحت تأثیر اشعه یا برخی مواد، غیر فعال نموده (به عنوان محرک)، و دیگری را به عنوان واکنشگر مورد استفاده قرار می دهند؛ به این آزمایش MLR یک طرفه گویند. غالباً نوع آنتی ژن سلول محرک مشخص است و از روی آن تفاوت یا تشابه لنفوسیت های پاسخ دهنده را معین می کنند. بدین ترتیب که اگر آنتی ژنهای هر دو نوع یکسان باشند سلولهای پاسخ دهنده تحریک نمی شوند، اما اگر اختلاف داشته باشند متعاقب آن تکثیر لنفوسیت های پاسخ دهنده بوقوع می پیوند. درجه تکثیر لنفوسیت ها را می توان با توانایی این سلول ها در جذب تایمیدین رادیواکتیو در DNA مورد سنجش قرار داد.
فلوسایتومتری
از این آزمایش میتوان برای بررسی عملکرد سلول های T به طور غیر مستقیم استفاده نمود. فلوسايتومتري روشی دقیق و با کارایی بالا که براي شناسايي سلولها و ارزيابي ویژگی های آنها به كار ميرود. این تکنیک بر اساس پراکنده سازی نور توسط سلولهای مورد آزمایش و انتشار فلورسانس از آنها استوار است. نشر فلورسانس با استفاده مستقیم از فلوروكرومهاي متصل شونده به اجزای سلولي یا ترکیبی از رنگ فلورسنت با آنتی بادیهای مونوکلونال حاصل میشود. این آنتی بادیهای کونژوگه با فلورسانس میتوانند مولکولهای سطحی و یا ترکیبات داخلی سلولها را ردیابی کرده و به آنها متصل شوند و شناسایی انواع سلولهای موجود در یک جمعیت سلولی متنوع را توسط فلوسایتومتری امکانپذیر نمایند. در این روش از آنتی بادی های مونوکلونال ویژه مولکول های سطحی لنفوسیت های T نظیر CD2 وCD3 کونژوگه با مواد فلورسنت (برای بررسی کل سلول های T) ، CD4 (بررسی سلول های T کمکی) و CD8 (بررسی سلول های T سیتوتوکسیک) استفاده می شود.
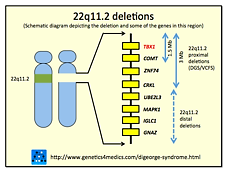
- آپلازی مادرزادی تیموس (سندرم دی جرج) ناهنجاری کروموزومی است که در اثر حذف کوچکی در کروموزوم ۲۲ اتفاق می افتد. این حذف در بخش میانی کروموزوم بر روی بازوی بلند در ناحیه q 11.2 ایجاد می شود این بیماری از مهمترین اختلالات لنفوسیتهای T است. در این بیماری غده تیموس و غدد پاراتیروئید کوچکتر از حد عادی بوده و تکامل نمی یابند. عدم تکامل تیموس که در طی دوران کودکی وظیفه تولید و تکامل لنفوسیتهای T را به عهده دارد منجر به عفونت های مکرر در این افراد می شود. همچنین اختلال در عملکرد پاراتیروئید باعث ترشح کمتر PTH از این غده می گردد که این امر باعث بروز هیپوکلسیمی و متعاقب آن هیپرفسفاتمی در کودک مبتلا می شود. ناهنجاری های قلبی، مشکلات تنفسی، نارسایی های کلیوی، سطح کلسیم پایین در خون، کاهش میزان پلاکت خون ، شکاف کام (شکافی در سقف دهان)، عفونت های مکرر، برخی اختلالات خودایمنی پیشرفته نظیر روماتوئید آرتریت، بیماری گریوز و تاخیر در رشد و نمو از نشانه ها ی این بیماری می باشند.
- کاندیدیازیس جلدی – مخاطی مزمن عفونت غشاهای مخاطی، پوست و ناخن ها است که بوسیلهقارچ کاندیدا آلبیکنس ایجاد میشود. این بیماری با اختلال در عملکرد لنفوسیتهای T همراه است. این بیماری در زنان و مردان دیده میشود. این اختلال ممکن است همراه با اختلالات متعدد غدد درونریز مثل نقص در غدد فوق کلیوی یا غدد پاراتیروئید ، بخصوص بیماری آدیسون که علت اصلی مرگ و میر این بیماران است، باشد.
- نقص مختلط و شدید سیستم ایمنی (SCID) ، دسته ای از اختلالات سیستم ایمنی میباشند که علت آنها عدم توانایی سلولهای مادر و خونساز در تکامل به لنفوسیتهای T و یا لنفوسیتهای B و اختلال در عملکرد این سلولهاست. در این بیماریها ، کاهش شدیدی در تعداد لنفوسیتهای خون مشاهده میشود. این افراد در معرض بسیاری از عفونت ها قرار دارند. از این نوع بیماریها میتوان به نقص درآنزیم آدنوزین دآمیناز ، بیماری آتاکسی تلانژکتازی و سندرم ویسکات – آلدریچ اشاره کرد.
- نقصهای ثانویه سیستم ایمنی ممکن است در پی از دست دادن لنفوسیتهای B یا T یا اختلال در عملکرد آنها در اثر بیماریهایی مانندلوسمی که در آن سلولهای سرطانی جانشین سلولهای عادی میشوند، بوجود بیاید. تاکنون شایعترین علت اختلال ثانویه سیستم ایمنی در کشورهای پیشرفته ، مصرف داروهای شیمیایی برای درمان سرطان بوده است. بسیاری از داروها برای سلولهای مغز استخوان و لنفوسیتهای B و T سمی هستند.
- سندرم نقص اکتسابی ایمنی (Acquired immune deficiency syndrome) نوعیبیماری است که در دستگاه ایمنی و توسط ویروس نقص ایمنی (HIV) ایجاد میشود. بیماری ناشی از ویروس HIV دارای سه مرحله اصلی است. در مرحله اول (عفونت حاد) به فاصله ۴ – ۲ هفته پس از عفونت ، ضعف عمومی و علایم دیگر ظاهر میشود که همگی بعد از ۲ – ۱۱ هفته بهبود مییابند. مرحله دوم بیماری تا یک دوره طولانی بدون هیچ علائمی دنبال می شود (دوره نهفته). هر چه بیماری پیشرفت یابد، تداخل بیشتری بادستگاه ایمنی بدن پیدا میکند و باعث میشود که افراد به عفونتهایی مانند عفونت فرصتطلب و تومور دچار شوند، البته به طور معمول در افرادی که دستگاه ایمنی آنها به خوبی عمل میکند تأثیرگذار نیست. در نهایت بیماری زمانی وارد مرحله سوم یا ایدز خواهد شد که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد.
بررسی عملکرد بیگانه خواری
فاگوسیتوز (بیگانه خواری) فرآیندی است که طی آن ذرات خارجی و میکروب ها توسط غشای سلولی احاطه شده و به صورت وزیکول وارد سلول می شوند، و در آنجا به وسیله مکانیسم های آنزیمی و غیره هضم می شوند. این عمل در بدن توسط فاگوسیت های تک هسته ای (مونوسیت ها و ماکروفاژها) و فاگوسیت های چند هسته ای (نوتروفیل ها) انجام می شود. برای ارزیابی فاگوسیت ها باید آن ها را به لحاظ تعداد و عملکرد بررسی نمود. در بعضی از بیماری ها نظیر آگرانولوسیتوز ارثی و نوتروپنی دوره ای تعداد سلول های بیگانه خوار کاهش می یابد و همین امر موجب بیماری می شود. در چنین مواردی شمارش کامل و افتراقی سلول های خونی در تشخیص کمک کننده خواهد بود. ارزیابی هر یک از پدیده های کموتاکسی، فاگوسیتوز و کشتن باکتری در داخل سلول در آزمایشگاه می تواند در بررسی عملکرد سلول های بیگانه خوار مفید باشد که نیاز به آزمایشگاه های مجهز و تخصصی دارد. در حال حاضر آزمایشات ساده تری وجود دارند که با ارزیابی روند متابولیک همراه با فاگوسیتوز به بررسی عملکرد بیگانه خواری می پردازند.
بیماری گرانولوماتوز مزمن (Chronic granulomatous disease, CGD) یک ناهنجاری اولیه دستگاه ایمنی است که در آن فاگوسیت های سیستم ایمنی ذاتی دارای نقص می باشند. بیماران مبتلا به CGD دارای حساسیت بالایی به عفونت های شدید باکتریایی و قارچی هستند. این بیماری به دو صورت وابسته به کروموزوم X و یا کروموزوم غیر جنسی (اتوزومال مغلوب) به ارث میرسد. علت این بیماری جهش در یکی از ژنهای کدکننده کمپلکسهای پروتئینی با نام کمپلکس اکسیداز فاگوسیتی (Phox) یا آنزیم NADPH اکسیداز میباشد، آنزیمی که تولید رادیکال های اکسیژن کشنده میکروبها را به عهده دارد. در طی پاسخهای دفاعی بدن در برابر میکروبها، فعالسازی کمپلکس آنزیمی مذکور با احیای اکسیژن مولکولی، موجب تولید ترکیبات ROS مثل رادیکال های پراکسید یا سوپراکسید میشود. رادیکالهای آزاد اکسیژن باعث ایجاد رادیکال های آزادی چون رادیکال هیدروکسیل، پروکسید و اسیدهای هایپوهالوس
می گردند که فعالیت های ضد میکروبی دارند، این فرآیند انفجار تنفسی (Respiratory burst) نام دارد.در بیماری CGD ناشی از نوع هتروزیگوت وابسته به X، فعالیت اکسیداتیو نوتروفیل ها طبیعی است و تنها راه شناسایی این افراد از طریق آزمایشات ژنتیکی
می باشد. در صورتی که در نوع هموزیگوت وابسته به x، فعالیت اکسیداتیو نوتروفیل ها دچار اختلال می گردد. همچنین راه شناسایی بیماران اتوزوم مغلوب به دلیل اینکه فاقد علائم بالینی می باشند، آزمایشات ژنتیکی می باشد.
بیماری CGD اغلب در دوران کودکی ایجاد شده و با عفونتهای مکرر قارچی و باکتریهای داخلسلولی کاتالاز مثبت (که پراکسید هیدروژن را تخریب میکنند) همراه است. بعلت نقص در کشتن میکروبهای فاگوسیتشده، لنفوسیتهای T باعث فعالکردن مداوم و مزمن ماکروفاژها شده و سبب ایجاد گرانولوما میشود.
آزمایش NBT (Nitro Blue Tetrazolium Test)

- آزمایشNBT برای بررسی اختلال عملکرد انفجار اکسیداتیو نوتروفیل ها در بیماران مبتلا به بیماری گرانولوماتوز مزمن (CGD) استفاده می شود
- این آزمایش همچنین درتشخیصافراد با عفونت های مکرر در استخوان، پوست، مفاصل، ریه ها و دیگر قسمت های بدن به کار می رود.
- آزمایش NBT در افراد طبیعی در صورتی که همراه با تحریک سلول های چند هسته ای به عمل فاگوسیتوز NBT باشد، بیش از ۸۰ درصد نوتروفیل ها مثبت می شوند. این درصد در بیماران مبتلا به گرانولوماتوز مزمن به کمتر از ۸۰ درصد می رسد. در صورت عدم تحریک، کمتر از ۱۰ درصد سلول های چند هسته ای در افراد طبیعی NBT مثبت می گردند. در این آزمایش تحریک توسط PMA (Phorbol myristate acetate) در ترکیب خون و NBT صورت می گیرد.
- آزمایشNBTدر افتراق عفونتهای باکتریایی از ویروسی و سایر عفونتها به دلیل نتایج منفی کاذب و مثبت کاذب قابل اطمینان نمی باشد.
توجه:
- خون حاوی هپارین یا EDTA برای آزمایش NBT استفاده می شود.
- بعد از انجام نمونه گیری نمونه باید بلافاصله به آزمایشگاه ارسال گردد.
- نمونه دارای لخته یا همولیز شدید در آزمایش تداخل ایجاد می نماید.
آزمایش DHR (Dihydrorhodamine) 123 assay
این آزمایش برای تشخیص بیماران مبتلا به CGD، شناسایی ناقلین CGD وابسته به X و اتوزوم مغلوب و ارزیابی فعالیت NADPH اکسیداز استفاده می شود. تشخیص آزمایشگاهی CGD بر ارزیابی عملکرد NADPH اکسیداز در نوتروفیل ها با استفاده از آزمایش NBT و یا آزمایش حساس و دقیقتر DHR استوار می باشد. بعبارتی اندازه گیری غیر مستقیم واسطه های فعال اکسیژن تولید شده توسط NADPH اکسیداز از طریق سنجش DHR میسر می شود بدین ترتیب که فعال شدن نوتروفیل ها با PMA موجب اکسیداسیون DHR به ترکیب فلورسانس رودامین ۱۲۳ می گردد که این ترکیب توسط فلوسایتومتر قابل شناسایی می باشد. فلوسایتومتری قادر به تشخیص اشکال مختلف ژنتیکی CGD می باشد.
آزمایش DHR روش بسیار دقیق و حساس نسبت به روش هایی مانند NBT می باشد. در آزمایشDHR ، میزان فلورسانس در حداقل ده هزار سلول با دستگاه فلوسایتومتر بررسی شده و با سلول های تحریک نشده مقایسه می شوند در حالی که در آزمایشNBT، فاگوسیتوز به طور معمول در صد سلول با میکروسکوپ معمولی بررسی می گردد.
بررسی عملکرد سیستم کمپلمان
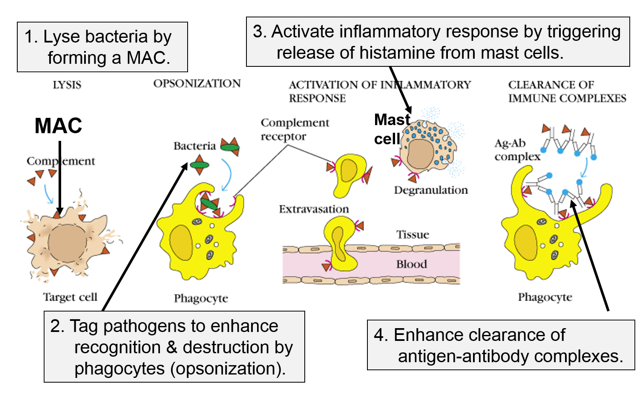
کمپلمان یک سیستم منظم با بیش از ۲۰ پروتئین سرم است که نقش بسیار مهمی در حفاظت بدن مقابل عوامل خارجی مانند میکروارگانیسم ها که به بدن حمله می کنند و همچنین ایجاد ضایعات التهابی دارد. فعالیت کمپلمان به شکستن پی در پی اجزای کمپلمان وابسته است که این پاسخ نهایی را تقویت می کند و موجب تولید بسیاری از محصولات ناشی از شکسته شدن کمپلمان می گردد که بعضی از آنها فعالیتهای بیولوژیک مهم را انجام می دهند. سیستم کمپلمان تحت کنترل دقیق عوامل تنظیم کننده، با یکدیگر و یا سایر مولکول های سیستم به منظور
از بین بردن میکروب ها میان کنش می دهند. سیستم کمپلمان در ایمنی ذاتی و تطبیقی نقش حائز اهمیتی دارد. این سیستم ممکن است از طریق مسیر کلاسیک، آلترناتیو و یا لکتین فعال شود. اجزای اختصاصی مسیر کلاسیک C1،C2 و C4 و اجزای اختصاصی مسیر آلترناتیو B، D و پروپردین هستند. اجزای اختصاصی مسیر لکتین شامل لکتین متصل شونده به مانوز (MBL)، سرین پروتئاز مرتبط با MBL نوع یک و سرین پروتئاز مرتبط با MBL نوع دو می باشند. سایر فاکتورها نظیر C3 و C5,6,7,8,9 در هر سه مسیر وجود دارند. پروتئین های تنظیمی ویژه ای وجود دارند که در صورت کمبود یا فقدان آن ها فعالیت سیستم کمپلمان به درستی انجام نمی گیرد. بررسی عملکرد سیستم کمپلمان شامل ارزیابی عملکرد کلی کمپلمان، ارزیابی تک تک فاکتورهای کمپلمان و بررسی پروتئین های تنظیمی کمپلمان می باشد.
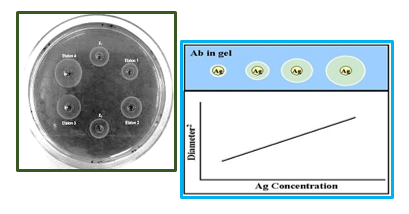
روش (SRID (Single Radial Immune Diffusion

روش الیزا (ELISA)
روش اليزا از متداول ترين و معروفترین روشهاي ایمونواسی به شمار مي آيد. ELISAه(Enzyme-Linked Immunosorbent Assay) يك روش بيوشيميايي ساده با حساسيت بسيار بالا است كه امكان آناليز تعداد زيادي نمونه را به طور همزمان و بصورت کمی فراهم مي كند. اساس روش الایزا بر پایه کمپلکس آنتی ژن-آنتی بادی استوار است. در این روش با استفاده از خواص منحصر به فرد آنتی بادی شامل قدرت اتصال بالای آن به آنتی ژن (Affinity) و شناسایی دقیق و صحیح آنتی ژن ((Specificity)) بهره گرفته می شود تا بیومولکولهای مورد جستجو، شناسایی و اندازه گرفته شوند. همچنین جهت ایجاد سیگنال از آنزیم ها و سوبستراهایی که تولید رنگ می نمایند استفاده می شود . سپس رنگ ایجاد شده توسط دستگاه سنجیده می گردد. امروزه ELISA يكي از قدرتمند ترين روش هاي آزمايشگاهي براي پي بردن به اختلالات سيستم ايمني است، اين آزمایش به منظور پي بردن به آنتيژن ناشي از ارگاني عفوني در بدن كه معرف برخي بيماريها است انجام مي شود. همچنين آنتي باديهايي كه در پاسخ به برخي عفونتها يا بيماريها بهوجود آمده نيز توسط اين آزمایش قابل تشخيص هستند. غلظت سرمی پروتئین های تنظیمی کمپلمان نظیر C1 Inhibitor را می توان با روش الیزا مورد بررسی قرار داد. در اين روش بسته به نوع آزمايش، آنتي بادي و يا آنتي ژن توسط آنزيم نشاندار مي شود. اليزا به روشهاي مختلفي انجام مي شود اما به هر حال يكي از اجزاي ايمونولوژيك يعني آنتي ژن يا آنتي بادي بايد به فاز جامد متصل گردد.اولین مرحله انجام الیزا پوشش دادن سطح جامد با آنتی ژن یا آنتی بادی می باشد. رایج ترین نوع فاز جامد روش الایزا پلیت های ۹۶ خانه است که در ۸ ردیف و ۱۲ ستون سازمان یافته اند و از ماده پلی وینیل کلراید (با قابلیت انعطاف) و یا پلی استیرن (غیر قابل انعطاف) تهیه شده اند. پلیت ها تفاوت های اندکی با هم دارند. پلیت ها با چاهک های ته صاف برای انجام آزمایشاتی مناسب هستند که در نهایت سنجش رنگ آنها با دستگاه اسپکتروفتومتر اندازه گیری می شود. پلیت ها با چاهک های ته گرد برای انجام تستهایی مناسب هستند که در نهایت سنجش رنگ آنها با چشم صورت می گیرد. چنین پلیت هایی برای سنجش توسط اسپکتروفتومتر مناسب نیستند.
ویژگی اصلی فاز جامد این است که آنتی ژن ها یا آنتی بادی ها به راحتی با استفاده از جذب پاسیو به سطوح آن متصل می شوند این فرآیند معمولا کوتینگ نامیده می شود. اتصال اکثر پروتئین ها به سطوح پلاستیکی احتمالا از طریق میانکنش های هیدروفوبیک زیرساختارهای غیرقطبی پروتئین ها و ماتریکس پلاستیکی می با شد. سرعت میانکنش های هیدروفوبیک به دما (هر چه دما بالاتر، سرعت بیشتر است)، غلظت بالای پروتئین و حرکت دادن پلیت بستگی دارد.
برای انجام شستشو در پلیت های الیزا دستگاه هایی به نام ELISA Washer طراحی شده است امکان شستشو را به صورت ردیفی و یا کل پلیت به صورت همزمان فراهم کرده است. اما امکان شستشوی دستی نیز وجود دارد.
اسپکتروفتومترهای خاصی برای سنجش رنگ در پلیت های الیزا طراحی شده اند که ELISA Reader نام دارند که با استفاده از یک برنامه نرم افزاری در این دستگاه ها امکان رسم منحنی و تعیین میزان نمونه مجهول به راحتی میسر شده است.
اندازه گیری قدرت همولیتیکی کمپلمان (Total hemolytic complement assay 0r CH50 assay)

عملکرد کل آبشار کمپلمان توسط CH50 ارزیابی می شود که قدرت سرم بیمار را برای لیز سلولهای خونی بیگانه ارزیابی می کند. قدرت همولیتیکی کمپلمان را با واحد CH50 unitه(۵۰% Hemolytic Unit of complement) و یا با واحد HD50 unitه(Hemolytic Dose) نشان می دهند. یک واحد CH50 عبارت است از مقدار یا تیتری از سرم که برای لیز ۵۰ درصد گلبول های قرمز حساس شده لازم است. در این آزمایش مقدار معینی از گلبول های قرمز حساس شده را در لوله های آزمایش ریخته و سپس به آن مقادیر متغیری از سرم بیمار را اضافه می کنند. مقدار طبیعی واحد CH50 سرم افراد رقم ثابتی نمی باشد و بستگی به موادی دارد که در هر آزمایشگاه برای اندازه گیری قدرت همولیتیکی کمپلمان مصرف می شود و بصورت استاندارد در آمده است. بهترین استفاده از CH50 برای تعیین کمبود یکی از پروتئین های انتهایی کمپلمان است برای مثال در یک بیمار با عفونت های مکرر نایسریا همراه با کمبود C5-9، اندازه گیری C4,C3 طبیعی خواهد بود اما CH50 بسیار پایین خواهد بود.
منابع برگزیده:
- روش های عملی در ایمونولوژی تالیف آقای دکتر وارسته و همکاران
- Abbas A, Lichtman A: cellular and molecular Immunology, fifth edition, 2003
- http://www.mayomedicallaboratories.com
- https://medlineplus.gov
- https://www.ncbi.nlm.nih.gov
عزيزاني که ساکن اهواز هستند ميتوانند از آزمايشگاه پاستور اهواز با بهترين امکانات و تکنولوژي روز، جهت هر نوع آزمايشي استفاده نمايند.
با تشکر مديريت سايت آزمايشگاه اهواز – پاستور

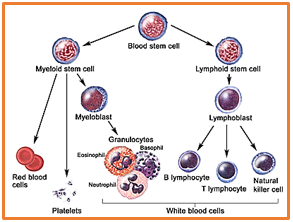






با سلام. فرق بین لنفوسیت B و T از نظر شکل ظاهری چیست؟ با تشکر.
سلام ، سوال دوم ، T cell و B cell از نظر ظاهری شبیه هم میباشند و در اسمیر خون محیطی در حالت نرمال مشابه هم هستند مگر اینکه در برخی موارد بیماری احتمال حدس زدن و تفرق این دو از یکدیگر ممکن و محتمل میباشد ولی چنانچه بطور قطعی بخواهیم این دو را از هم تفکیک نماییم باید به کمک منوکلونال آنتی بادیهای اختصاصی و مشخص نمودن CD مارکرهای سلولی و با دستگاه فلوسایتومتری این عمل انجام شود . امیدوارم بطور اجمالی پاسخ داده باشم